下面,请跟随发布君一起了解中国、美国、欧盟对于医用防护服各自的执行标准以及相关认证认可要求。
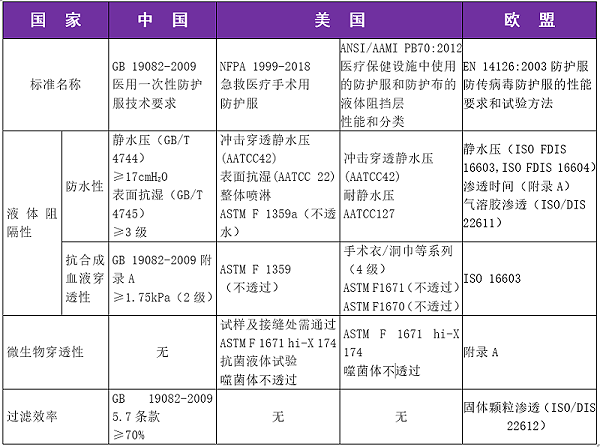
中国医用防护服执行国家标准GB 19082-2009《医用一次性防护服技术要求》,该标准为强制性,针对医用一次性非织造防护服,没有对可重复使用的防护服作出规定。
美国的医用防护服标准是由NFPA(美国车家防火协会)制定的NFPA1999,适用于医疗急救时美国医疗器具开发协会组织制定的AAMIPB-70,适用于评价卫生用防护服装的阻隔性能。
欧盟颁布了EN14126-2003防护服防病毒防护服的性能要求和试验方法,该标准主要关注点为防护服的耐血液、体液和病毒的穿透性
1中国
国内基于风险通常把医疗器械分成三类:第一,风险低的和基本没有风险的属于一类,在地市局药品监管部门机构备案。第二,中等风险的医疗器械由省一级药品监管部门注册审批。第三,高风险的医疗器械属于三类,由国家局直接负责组织审批。
2美国
美国食品与药物管理局(FDA)根据风险等级将医疗器械产品分为三个等级进行管理,一级指普通产品,二级指通过特殊控制来保证其安全性和有效性的产品,三级指一般用来支持人体生命,防止人体健康受损,具有治病、致残的潜在不合理风险的产品。
美国医用防护服可分为非手术防护服和手术用防护服两类。非手术防护服属于I类医疗器械,免于上市前登记,直接进行机构注册。而手术用防护服属于II类医疗器械,需要进行上市前登记,即需要申请FDA 510K。
II类产品上市前要通告,基本流程如下
(1)产品测试(性能测试、化学测试)
(2)准备510K文件
(3)提交FDA评审
(4)FDA发510K批准
(5)完成工厂注册和机器列名
(6)产品出口
欧盟经济区市场涉及到安全、卫生、环境保护和消费者保护的商品(如电子、机械、医疗器械、玩具、个人防护设备、通讯、承压设备等)已经被强制性地列入“必须携带CE标记,否则不准进入欧盟市场流通”之列。
防护服属于个人防护用品,英文是Personal Protective Equipment,简称PPE,欧盟的个人防护用品安全指令是89/686/EEC。根据PPE指令的规定,按照PPE产品设计的复杂程度和防护级别将PPE产品分为三个类别。在欧洲市场销售的个人防护用品,必须符合适用的安全要求和标准。

医用防护服的“防护性能”是最为重要的性能要求,主要包括液体阻隔、微生物阻隔和对颗粒物质的阻隔等方面。我国2003年首次颁布了《医用一次性防护服技术要求》国家强制标准,并于2009年进行了修订,GB19082-2009《医用一次性防护服技术要求》中规定的性能指标相对较丰富。目前国际上较通用的医用防护服标准是美国美国国家职业安全卫生研究所(NIOSH)标准和欧盟的EN标准。下面就中美欧医用防护服标准中的防护性能进行简单比对。