
近期,新冠肺炎疫情在印度蔓延。呼吸机、制氧机作为抗击疫情重要的物资在印度需求量较大。小编紧急整理汇总出口印度医疗器械须知,向相关企业介绍如何顺利、有序向出口印度医疗器械 (下篇)。
出口印度医疗器械准入条件
1. 出口印度医疗器械的监管机构
印度卫生和家庭福利部(Ministry of Health & FW)下的中央药品标准控制局(Central Drug Standards Control Organization,简称CDSCO)为印度医疗器械的中央主管机构,其内部的重要组成机构印度药品管理总局( The Drug Controller General of India,简称DCGI )作为印度全国医疗器械政策的制定单位。
2.医疗器械的分类
2017年印度对医疗器械法规进行了大幅修订,公布了《医疗器械管理条例2017》( Medical Device Rules 2017),从2018 年 1月起实施,参照了“全球医疗器械法规调和会 ”(The Global Harmonization Task Force ,简称 GHTF),将医疗器械分为A 到 D四类,对应从低风险到高风险四种风险级别。
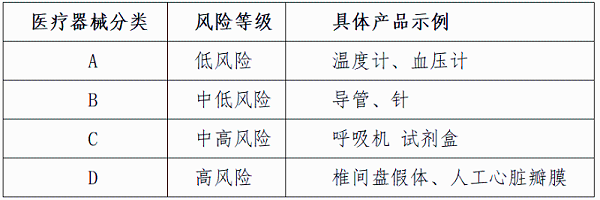
印度CDSCO在2017 年也发布了《医疗器械与体外诊疗医疗器械分类标准》,印度要求在申请产品登记时,应遵循印度药品管理总局(DCGI)针对医疗器械的分类决定。对于未能判断分类的情况,应向 CDSCO 提出分类申请。
3.出口印度医疗器械制造许可证的申请
出口印度医疗器械进行销售或使用,必须经印度当地授权代理人(authorised agent)向 CDSCO提出医疗器械进口许可证申请(包括A至 D 级)。CDSCO对医疗器械进口许可证的审核主要分为两步:
第一步:确认生产企业质量管理体系(Quality Management System,简称QMS)的符合性
首先CDSCO审核授权代理人所提交的生产企业质量管理体系,其必须符合印度医疗器械质量管理标准 ICMED 13485(修改采用自ISO 13485,我国标准 YY/T 0287等效采用了ISO 13485),包括:生产企业 QMS技术文件、检测报告、最近一次现场检查报告等,如果CDSCO 认定生产企业 QMS的符合存在疑虑时,可以要求实施评估、产品检测或生产企业现场检查(费用由医疗器械代理人承担)。
第二步:审核出口印度医疗器械代理产品的安全性与有效性
如果出口印度的医疗器械分类属于A级或者B 级,授权代理人应向CDSCO提交中国的自由销售证明,或者中国实施临床测试的数据(或其他可供证明产品安全性与有效性的数据)。如果出口印度的医疗器械分类属于 C 级或者D级,授权代理人必须在印度实施临床测试。
例外情况:如果医疗器械(A级至D 级)已由欧盟、美国、加拿大、日本或澳大利亚的监管机构颁发了自由销售证明,则无需再进行临床测试。
4. 出口印度医疗器械代理产品标签
印度《医疗器械管理条例2017》第44 条至48条对医疗器械的标签进行了要求。
出口印度医疗器械代理产品标签要求:该条例第44条规定,应用不可抹掉的墨水在医疗器械的架子包装上或医疗器械的外壳上以及在包装医疗器械的每个外壳上印刷以下内容。

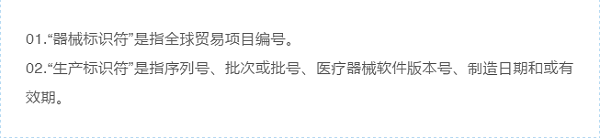
唯一的器械标识:条例第46条规定,自2022 年1月1 日起,经批准制造、销售、分销或进口的医疗器械应带有唯一的器械标识,其中应包含器械标识符和生产标识符。其中:
三、印度临时性政策
印度财政部已于2021年4 月24日发布第28/2021-Customs 公告,取消制氧机( HS 9019/HS 842139) 、呼吸机( HS 9019 )等 18项产品进口关税,至2021 年 7月31 日止。。
印度港口、航运暨水道部也于25日通知各主要港口,取消进口氧气及相关设备的港口处理费,给予优先泊船通关。港务人员必须严格控制船舶入港及货物通关时间,协助物流运作。
上海心航报关有限公司,为出口印度医疗器械的收发货人提供以报关为核心的物流供应链的服务,包括货物国内外航空货运、外贸代理、出口印度医疗器械代理公司报检、仓储运输、商务办证等一系列服务,出口印度医疗器械代理 咨询热线:4001332528
图文来源于12360海关热线,如若侵权联系删除